Preparación y envío de muestras por tipo
El envío de especímenes biológicos debe cumplir los protocolos establecidos por el servicio de mensajería o transporte utilizado. En algunos casos, el transporte aéreo requiere el cumplimiento de la normativa de la Asociación Internacional de Aviación y Transporte (IATA) para materiales peligrosos.
Pruebas Citológicas
En el caso de efectos de masa superficiales, la toma de muestras con aguja fina (es decir, aspiración o técnica de extracción de núcleos/«pájaro carpintero») suele tener un mayor rendimiento diagnóstico y ser más representativa de la lesión primaria que las muestras obtenidas mediante impresión superficial. Los frotis de impresión son propensos a contaminarse con restos y flora de la piel o del entorno, o pueden representar sólo una inflamación o infección secundaria.
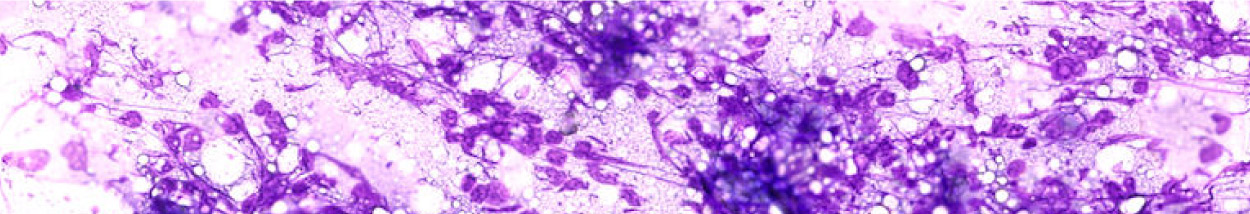
El material aspirado debe extenderse en una monocapa (es decir, aproximadamente la mitad de las células se tocan pero no se superponen) tras su aplicación al portaobjetos (Imágenes de linfocitos 1 y células mesenquimales 2)
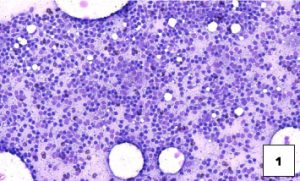
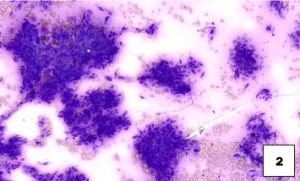
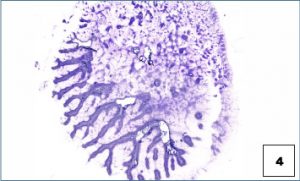
El método de extendido preferido consiste en un extendido horizontal suave utilizando un segundo portaobjetos que se coloca encima del material después de depositarlo en el portaobjetos inferior (véase imagen 3 de preparación óptima). Esta técnica es superior a la técnica pull-apart vertical (véase imagen 4 de preparación pull-apart).
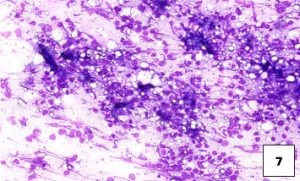
La densidad excesiva de las muestras y la citólisis inhiben la capacidad de evaluar adecuadamente las células en las muestras citológicas (véanse las diapositivas Densidad excesiva de las muestras bajo aumento 5 y alto aumento 6; véase también la diapositiva Citólisis excesiva (lisis celular) 7 ). Sólo las células intactas pueden evaluarse citológicamente porque la citólisis introduce artefactos que pueden simular malignidad, como el agrandamiento de los núcleos y el aumento de la prominencia de los nucléolos.

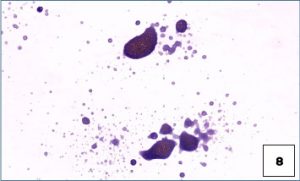
Tanto la técnica pull-apart como la falta de esfuerzo para extender el material (es decir, el simple secado al aire de material biológico depositado en forma de gota) son propensas a una densidad excesiva de la muestra y a la citólisis, y pueden no ser diagnósticas (véase muestra densa sin extensión en portaobjetos 8).
Las muestras con componente fluídico pueden extenderse de la misma manera que los frotis sanguíneos. Los fluidos muy celulares pueden untarse directamente; los fluidos de baja celularidad deben centrifugarse para concentrar las células.
Los portaobjetos deben conservarse a temperatura ambiente y protegidos del polvo, así como de la humedad excesiva y la exposición prolongada a la luz. Es importante etiquetar físicamente los portaobjetos con la identificación del paciente, así como la procedencia de la muestra citológica; etiquetar únicamente las cajas o cartones de portaobjetos no es fiable porque los portaobjetos pueden separarse de los recipientes o éstos pueden reutilizarse.
Las muestras que contienen un exceso de ultrasonidos o gel lubricante pueden no ser diagnósticas, ya que este material es opaco al microscopio y oculta las células, además de provocar una mala captación de la tinción celular.
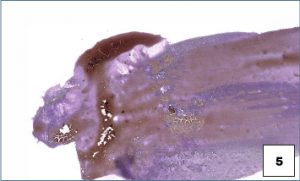
Otras consideraciones prácticas para la preparación de muestras citológicas son utilizar siempre portaobjetos frescos, evitar el uso de cubreobjetos y cinta de acetato, y asegurarse de que el material celular se deposita hacia el centro de una sola cara del portaobjetos (véase la muestra en ambos lados del portaobjetos 9).

A medida que se generaliza el escaneado digital de portaobjetos en los laboratorios de diagnóstico, no es posible que un patólogo simplemente dé la vuelta al portaobjetos en su microscopio para enfocar el material del portaobjetos opuesto. Además, si el material de ambos lados se superpone, es posible que el efecto neto sea un material demasiado grueso para evaluarlo adecuadamente
La exposición de frotis de sangre y citológicos a formalina o vapores de formalina (incluida la proximidad a frascos sellados de formalina) interferirá con la tinción y evaluación adecuadas, lo que puede dar lugar a una muestra no diagnóstica. Estas preparaciones en portaobjetos nunca deben enviarse al laboratorio en el mismo paquete que los tejidos fijados con formol.
Los frotis no fijados y secados al aire suelen ser adecuados para la tinción inmunocitoquímica (ICC); sin embargo, en algunos casos, se recomienda enviar las muestras en tubos que contengan medios de transporte. Si se prevén tinciones especiales, incluida la CCI, deberá contactarse con el laboratorio antes del envío para asegurarse de que se sigue el protocolo específico de su laboratorio.
